本文就小编在场听到的国内eCTD申报流程及注意事项,进行综合整理,如有遗漏或误解之处,欢迎各位在公众号留言,批评指正。
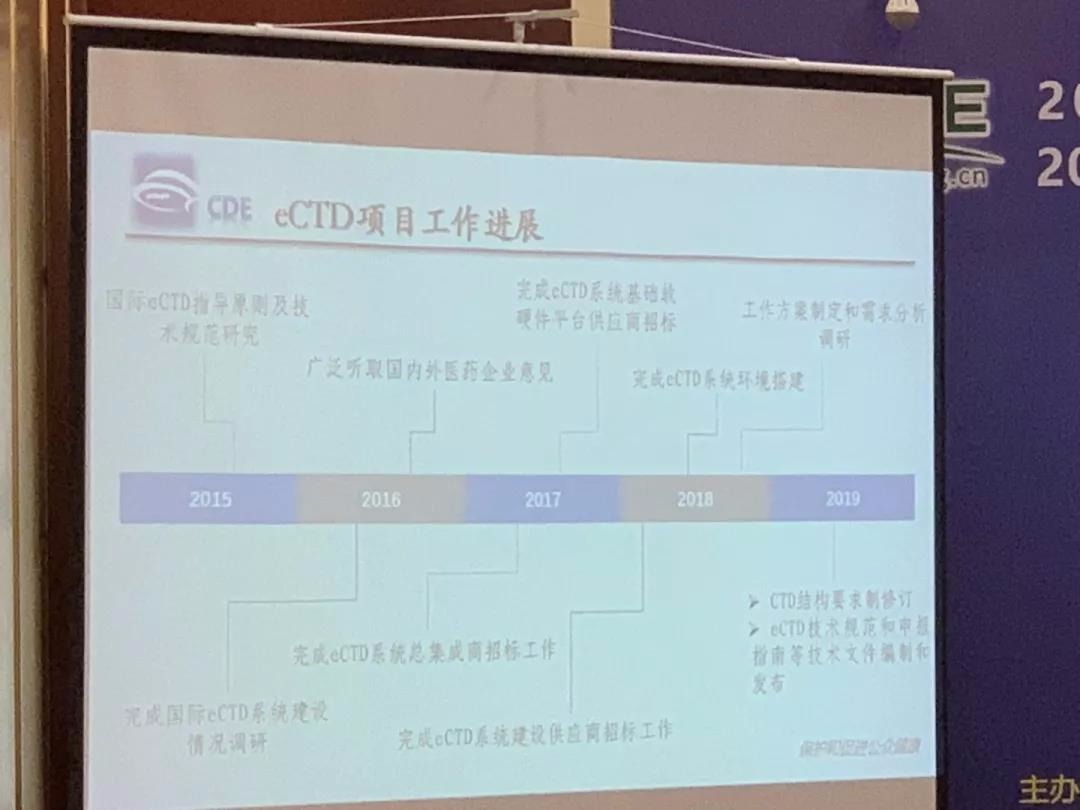
CDE即将颁布eCTD申报指南,目前CDE的评审端处于Ⅰ期工程即将完成的状态,Ⅰ期工程不会采用Gateway的形式递交,而是采用光盘递交的形式。(因为中国第一次执行,无论对于药企还是药审方都面临巨大挑战,保守起见所以先以光盘递交的形式)

企业除了递交光盘还要在eCTD文档通过审核后,10天内递交一份纸质资料。(中国档案管理有规定需要有完备的系统,系统建设可能还需要1年,为避免延误实行eCTD方式递交,所以就先采取eCTD与纸质文件并行的递交方式,也就是说预计一年后就可以不用再多交一份纸质文件了)

此图为CDE的eCTD申报流程图。

企业第一次申报时会给一个跟eCTD文件绑定的编号,无论报临床还是生产都是这个编号,但是跟受理号不一样,受理号仍然存在,该编号只是用于eCTD部分的执行。(这里面的解读小编可能有误区,仅供大家参考)
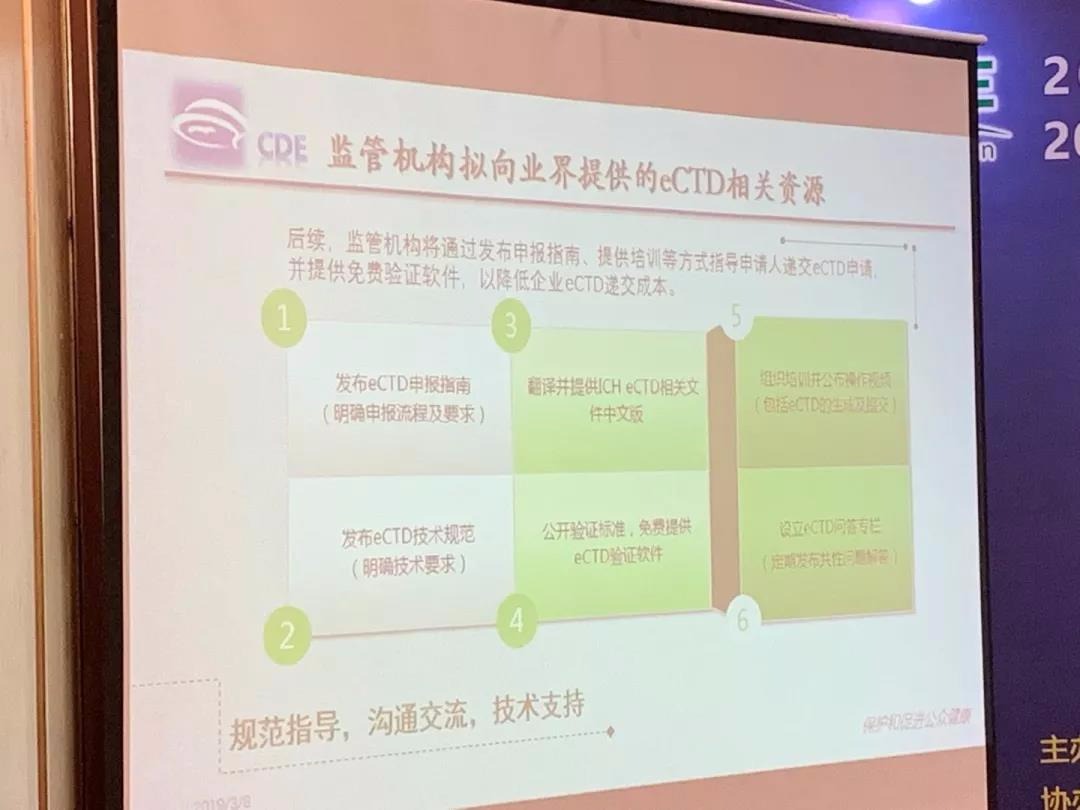
CDE会提供一系列对药企的支持,包括:发布eCTD申报指南、发布明确的eCTD技术规范、翻译提供ICH eCTD相关文件的中文版、组织培训eCTD、开设eCTD问答专栏,最重要的是:会对药企开放一个免费的eCTD验证器!

药企目前到了布局eCTD的时间,即使外包给CRO,也要自己熟知eCTD相关法规,如果自身品种很多,即使外包也要建立自己的电子文档管理系统。
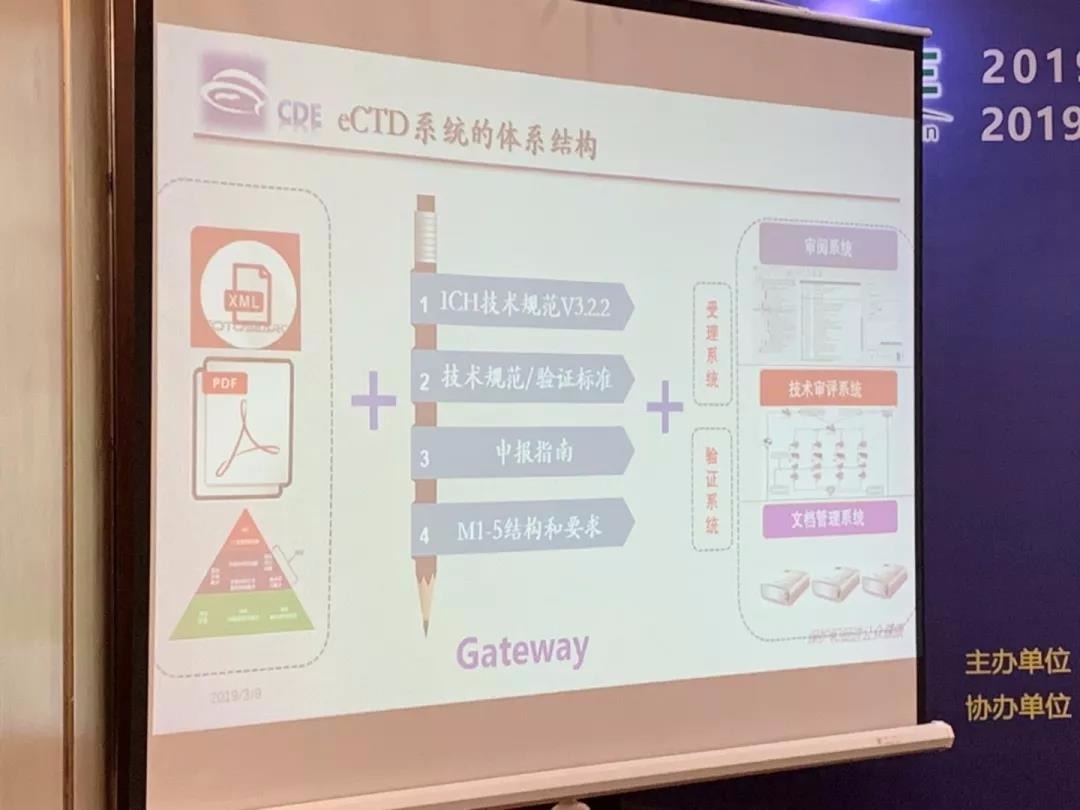
药企要深度学习CTD以及电子签章技术。

a、中国会同步全球,使用3.2.2版本的eCTD
b、语言肯定是中文
c、支持eCTD申报的药品大家可以参照10号文件,新药肯定最先支持eCTD申报,仿制药也可以eCTD申报。(小编理解是无论新药仿制药都可以eCTD申报,但如果将来强制执行新药是第一批强制的)
d、不出意外的话预计5月份开始执行eCTD申报。(敲重点)
e、肯定有过渡期,不会直接强制eCTD申报,过渡多久不确定
f、gateway递交预计在执行eCTD递交1年后。(2019年5月执行的话也就是,2020年5月就可以不用交光盘了,小编猜测到时可能也不用再递交一份纸质文件了)
g、如果是进口注册的话,那么要提供一份外文一份中文的eCTD文件,审核的话会审核中文的,外文的留作参考。(怕药企自己翻译错了)
下面是药企非常关注的问题,有观众现场向范处长提问,是否一定要采购中标方的eCTD产品?
观众:是否一定要买中标软件?
范处:我们会发布一个免费的验证软件,只要能通过中心发布的验证软件,不管是用哪家厂商软件生成的eCTD文件,我们都收。
以上就是当天会议,小编对现场收集的信息进行的总结,相信看完此篇文章,各位对于自身企业是否应该布局eCTD也已经有了一个答案。
对于企业无论是自己申报亦或是交由第三方处理,都需要熟读法规,同时建立完备的文档管理系统,eCTD是一个系统工程,而不是单独一款产品可以解决的。
DoubleBridge自2004年起,自主研发的Rosetta eCTD系列软件(发布、验证、存储与归档系统)享誉海内外,同时也是在全球范围内具有10年以上eCTD实施经验的唯一一家华人公司!北京和桥软件作为DoubleBridge在国内成立的全新品牌,有效规避了外企因中间代理商、时差、工作习惯导致的软件问题响应慢、本土优化差等问题。在中国医药eCTD电子化申报的大浪潮中,和桥软件将倾力服务中国药企全面信息化,确保申报资料合规性,不忘初心,砥砺前行!
西安研发中心:
咨询:+86 138-1177-9419
联系邮箱:yajun.zhang@qxutech.com


